


Nächste Seite: Elektronenkonfiguration
Aufwärts: Chemische Grundlagen
Vorherige Seite: Chemische Grundlagen
Inhalt
Der Atomaufbau
Bis zum Ende des 19. Jahrhunderts galten Atome als unteilbar und waren somit die kleinst möglichen Teilchen. Dann entdeckte man jedoch, daß ein Atom aus noch kleineren Teilchen besteht: den positiv geladenen Protonen, den ungeladenen Neutronen und den negativ geladenen Elektronen. Im Ganzen ist ein Atom neutral, da es aus ebenso vielen Protonen wie Elektronen aufgebaut ist. Atome desselben Elements sind dadurch charakterisiert, daß sie die gleiche Protonenanzahl haben. Sie können sich lediglich in der Anzahl der Neutronen unterscheiden, man spricht dann von Isotopen. Durch Elektronenaufnahme bzw -abgabe wird ein Atom negativ oder positiv geladen und dadurch zum Ion.
Anfang des 20. Jahrhunderts stellte Rutherford sein Atommodell vor. Er vermutete, daß ein Atom aus einem Atomkern und einer Atomhülle besteht. Der Atomkern wird dabei aus den Protonen und Neutronen gebildet. Die Atomhülle besteht demnach aus den Elektronen, die sich kreisförmig um den Atomkern bewegen. Der Aufbau der Elektronenhülle wurde dann durch Niels Bohr mit seinem Atommodell konkretisiert. Er postulierte, daß sich ein Elektron nur in ganz bestimmten Bahnen um den Kern bewegen kann. Diese Bahnen nennt man Schalen und werden von innen nach außen mit den Buchstaben K bis Q bezeichnet [UNI2003].
Zwischen den Schalen kann ein Elektron nicht existieren. Jede Schale entspricht einem individuellen Energieniveau. Ein Elektron auf einer kernnäheren Schale besitzt weniger Energie als ein Elektron auf einer kernferneren Schale. Es kann aber auf eine höhere Schale angehoben werden, indem man dem Elektron eine bestimmte Energiemenge zuführt. Diesen Zustand bezeichnet man als angeregt. Nach kurzer Zeit fällt es aber wieder in den Grundzustand zurück und gibt dabei die Energiedifferenz zwischen den beiden Schalen als Energiepaket wieder ab. Diese Energiepakete lassen sich in Form von Linienspektren darstellen. Jedes Element sendet ein individuelles Linienspektrum aus, wenn es mit ausreichend Energie versorgt wird. Atome mit höherer Ordnungszahl besitzen so komplizierte Linienspektren, daß sie mit dem bisherigen Atommodell nicht mehr erklärt werden konnten. Das Modell mußte also erweitert werden.
Bislang besaß eine Schale ein einheitliches Energieniveau. Diese Anschauung verwarf man und unterteilte eine Schale in mehrere Energieniveaus. Um jeden einzelnen Energiezustand eines Elektrons genau beschreiben zu können, wurden vier Quantenzahlen eingeführt: die Hauptquantenzahl n, die Nebenquantenzahl l, die magnetische Quantenzahl m und die Spinquantenzahl s. Die Elektronen eines Atoms müssen sich in mindestens einer dieser Zahlen unterscheiden, was auch als Pauli-Prinzip bezeichnet wird.
Tabelle 2.1:
Mögliche Quantenzustände bis n = 4
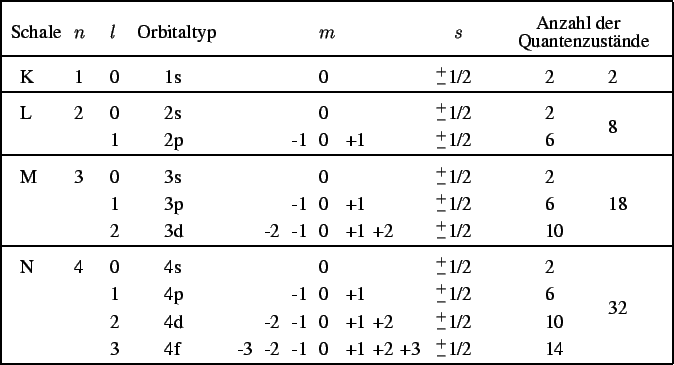 |
Die möglichen Quantenzustände bis n = 4 sind in Tabelle 2.1 dargestellt. Den bisherigen Energiestufen K bis Q ist die Hauptquantenzahl n zugeordnet. Die Schale K ist dem Wert 1 zugewiesen, die Schale L dem Wert 2, usw. Jede Energiestufe kann aber nicht die gleiche Anzahl von Elektronen aufnehmen. Die maximale Elektronenanzahl ist von n abhängig und beträgt 2n2. Wie bereits erwähnt, wird eine Schale in mehrere Energieniveaus unterteilt, die durch die Nebenquantenzahl l genau gekennzeichnet werden. l kann dabei Werte zwischen 0 und n - 1 annehmen. Bislang kennt man jedoch nur Atome, bei denen die ersten vier Energieniveaus einer Schale mit Elektronen besetzt sind. Diese werden mit den Buchstaben s, p, d und f bezeichnet. Zudem wird jedes Energieniveau noch in 2l + 1 Orbitale aufgeteilt. Die verschiedenen Orbitale werden durch die magnetische Quantenzahl m gekennzeichnet, die die ganzzahligen Werte von - l bis l annehmen kann. Jedes Orbital kann maximal zwei Elektronen aufnehmen, die sich jedoch in der Spinquantenzahl s unterscheiden müssen. s kann nur die Werte -1/2 und 1/2 annehmen. Da n die möglichen Werte für die Nebenquantenzahl bestimmt und diese wiederum die Werte der magnetische Quantenzahl beschränken, sind nur bestimmte Kombinationen der Quantenzahlen möglich.
Die Atomorbitale lassen sich auch grafisch darstellen. Dies bildet eine anschauliche Grundlage bei der Erklärung von chemischen Bindungen. Das Aussehen hängt direkt von den Quantenzahlen n, l und m ab:
- n
- bestimmt die Größe des Orbitals
- l
- bestimmt die Gestalt des Orbitals
- m
- beschreibt die räumliche Orientierung
Atomorbitale sind aber keine starren Gebilde. Sie können weder gemessen noch beobachtet werden. Sie stellen vielmehr Aufenthaltsräume dar, in denen sich die Elektronen mit hoher Wahrscheinlichkeit bewegen.
Abbildung 2.1:
Darstellung der s- und p-Orbitale
|
|
Unterabschnitte



Nächste Seite: Elektronenkonfiguration
Aufwärts: Chemische Grundlagen
Vorherige Seite: Chemische Grundlagen
Inhalt
Oliver Krone
2003-04-28
