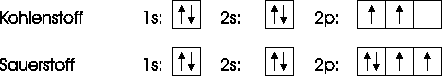


Nächste Seite: Die Atombindung
Aufwärts: Der Atomaufbau
Vorherige Seite: Der Atomaufbau
Inhalt
Elektronenkonfiguration
Die Verteilung der Elektronen auf die jeweiligen Orbitale wird Elektronenkonfiguration genannt und ist für jedes Element charakteristisch [Huhe1988]. Sie basiert auf drei einfachen Regeln:
- Elektronen belegen zuerst die energieärmsten Niveaus
- Energiegleiche Orbitale mit gleicher Nebenquantenzahl werden zunächst einfach besetzt.
- Jedes Orbital kann maximal zwei Elektronen mit unterschiedlicher Spinquantenzahl aufnehmen.
In Abbildung 2.2 sind zwei Elektronenkonfigurationen abgebildet. Die Kästchen stellen die Atomorbitale dar und die Elektronen werden durch die Pfeile symbolisiert. Der unterschiedliche Spin ist durch die Pfeilrichtung dargestellt. Das 1s-Orbital wird zunächst mit zwei Elektronen besetzt, da es das energieärmste Orbital ist. Danach wird das 2s-Orbital belegt. Sowohl beim Kohlenstoff als auch beim Sauerstoff sind noch Elektronen übrig, um die 2p-Orbitale zu besetzen. Beim Kohlenstoff belegen die beiden letzten Elektronen je ein eigenes Orbital. Beim Sauerstoff hingegen muß ein Orbital doppelt besetzt werden. Die beiden Elektronen haben dabei aber einen unterschiedlichen Spin.
Abbildung 2.2:
Konfigurationen des Kohlen- und Sauerstoffs
|
Oliver Krone
2003-04-28