|
|
Der Faktor c wird Schomaker-Stevenson-Koeffizient genannt und ist davon abhängig, welche Atome an der Bindung beteiligt sind. Ist ein Atom der zweiten Periode an der Bindung beteiligt, hat der Koeffizient den Wert 0, 08 Å. Sind andere Atome an der Bindung beteiligt, kann der Koeffizient nur noch 0, 02 Å betragen.
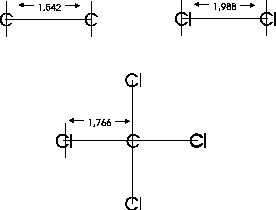
Mit dieser Methode lassen sich die Längen verschiedener Atombindungen abschätzen. Dennoch kann man nicht alle Längen befriedigend vorhersagen, denn auch benachbarte Strukturen haben Einfluß auf die Bindungslänge. So wird z.B. eine Bindung von einer benachbarten Doppelbindung verkürzt. Die Doppelbindungen im
H2C--C--CH2 sind 0,024 Å kürzer als normal. Im Allgemeinen kann man davon ausgehen, daß eine Bindung durch eine benachbarte Doppelbindung geringfügig um etwa 0,02 Å verkürzt wird [Paul1968].
Die Kovalenzradien sind so definiert worden, um die Länge von Einfachbindungen vorhersagen zu können. Man kann aber auch die Länge von Doppelbindungen abschätzen. In der Regel sind die kovalenten Radien bei Doppelbindungen um ca. 0,105 Å kleiner. Demnach ist eine Doppelbindung um ca. 0,21 Å kürzer als die entsprechende Einfachbindung. Dreifachbindungen sind sogar um ca. 0,34 Å verkürzt.