


Nächste Seite: Die Bindungslänge
Aufwärts: Chemische Grundlagen
Vorherige Seite: Elektronenkonfiguration
Inhalt
Die Atombindung
In der Chemie unterscheidet man im Wesentlichen zwischen drei verschiedenen Bindungstypen:
- der Atom- bzw. kovalente Bindung
- der Ionenbindung
- der metallischen Bindung
In Molekülen sind die einzelnen Atome in der Regel durch kovalente Bindungen miteinander verbunden. Eine Bindung läßt sich aber im Allgemeinen nicht eindeutig einem Bindungstyp zuordnen. Es liegt meistens eine Mischform zwischen den verschiedenen Bindungsarten vor. Die drei Bindungsarten haben jedoch eines gemeinsam: Atome versuchen immer den energetisch günstigsten Zustand zu erreichen. Einen energetisch günstigsten und somit stabilen Zustand nimmt ein Atom ein, wenn es die Konfiguration eines Edelgases besitzt, d.h. die jeweiligen Schalen voll besetzt sind.
Als kovalente Bindung bezeichnet man die Bindung zwischen Nichtmetallatomen. Anders als bei einer Ionenbindung, bei der eine Elektronenübertragung stattfindet, werden bei einer Atombindung zwei Atome durch ein gemeinsames Elektronenpaar gebunden. Das Elektronenpaar, das aus je einem Elektron eines Atoms gebildet wird, wird zu den Außenelektronen beider Atome gerechnet. Die Elektronen werden also doppelt gezählt. Sie halten sich aber in der Regel nicht zu gleichen Teilen bei den Atomen auf. Nur bei Molekülen aus zwei gleichartigen Atomen ist die Ladung des bindenden Elektronenpaares räumlich symmetrisch verteilt. Bei verschiedenen Atomen liegt der negative Ladungsschwerpunkt der Elektronen nicht genau zwischen den Atomkernen. Das eine Atom zieht die Bindungselektronen stärker zu sich heran als das andere Atom. Ein Maß für die Fähigkeit eines Atoms Elektronen in einem Molekül an sich zu ziehen, ist die Elektronegativität (EN). Besonders hohe Elektronegativitäten findet man bei kleinen Atomen mit hoher Kernladung. So ist Fluor das Element mit dem höchsten EN-Wert. Ihm wurde willkürlich der Wert 4.0 zugewiesen [ChMe1994]. Lithium hingegen hat einen EN-Wert von 0.98.
Die Entstehung einer Bindung beruht auf den elektrostatischen Wechselbeziehungen zwischen den Elektronen und den Atomkernen beider Atome. Kommen sich zwei Atome näher, so wirkt sich die Anziehung zwischen dem positiv geladenen Atomkern des einen und den negativ geladenen Elektronen des anderen Atoms immer stärker aus. Je näher sie sich kommen, desto größer wird die Anziehungskraft. Ab einem gewissen Abstand überwiegt jedoch die abstoßende Wirkung beider Atomkerne. Bei einem bestimmten Atomabstand ist aber die abstoßende und die anziehende Wirkung im Gleichgewicht und es entsteht eine Bindung. Dabei kommen sich die Atome so nah, daß sich zwei Atomorbitale überlappen. Durch diese Art von Überlappung entstehen 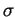 -Bindungen, die bei der Bildung von Einfachbindungen entstehen. Sind zwei Atome jedoch durch eine Mehrfachbindung miteinander verbunden, tritt zusätzlich noch eine andere Art von Überlappung auf, die
-Bindungen, die bei der Bildung von Einfachbindungen entstehen. Sind zwei Atome jedoch durch eine Mehrfachbindung miteinander verbunden, tritt zusätzlich noch eine andere Art von Überlappung auf, die 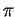 -Bindung. Sie wird in Abschnitt 2.2.2 näher erläutert.
Die Anzahl der Bindungen, die ein Atom eingehen kann, wird durch seine Elektronenkonfiguration bestimmt. Es können nur Elektronen der äußersten Schale, der Valenzschale, zur Bildung von Bindungen beitragen. Dabei muß das Elektron ungepaart sein, d.h. es ist das einzige Elektron in einem Orbital. Man darf aber nicht immer vom Grundzustand eines Atoms ausgehen, denn Kohlenstoff besitzt die Elektronenkonfiguration
1s22s22p2 (Abbildung 2.2) und könnte demnach nur zwei Bindungen eingehen. Als einfachstes Kohlenwasserstoff kennt man jedoch Methan (CH4). Das Kohlenstoffatom ist hier vierbindig.
Regt man ein Kohlenstoffatom an, so erhält es die Elektronenkonfiguration
1s22s12p3. Ein Elektron der 2s-Schale wird auf die nächst höhere 2p-Schale angehoben. Jetzt hat das Atom vier ungepaarte Elektronen und kann somit vier Bindungen eingehen. Atome von Elementen der 2. Periode können maximal vier Bindungen eingehen, da nur vier Atomorbitale zur Verfügung stehen. Dies wird auch als Oktettregel bezeichnet, da die Valenzschale nur acht Außenelektronen aufnehmen kann.
-Bindung. Sie wird in Abschnitt 2.2.2 näher erläutert.
Die Anzahl der Bindungen, die ein Atom eingehen kann, wird durch seine Elektronenkonfiguration bestimmt. Es können nur Elektronen der äußersten Schale, der Valenzschale, zur Bildung von Bindungen beitragen. Dabei muß das Elektron ungepaart sein, d.h. es ist das einzige Elektron in einem Orbital. Man darf aber nicht immer vom Grundzustand eines Atoms ausgehen, denn Kohlenstoff besitzt die Elektronenkonfiguration
1s22s22p2 (Abbildung 2.2) und könnte demnach nur zwei Bindungen eingehen. Als einfachstes Kohlenwasserstoff kennt man jedoch Methan (CH4). Das Kohlenstoffatom ist hier vierbindig.
Regt man ein Kohlenstoffatom an, so erhält es die Elektronenkonfiguration
1s22s12p3. Ein Elektron der 2s-Schale wird auf die nächst höhere 2p-Schale angehoben. Jetzt hat das Atom vier ungepaarte Elektronen und kann somit vier Bindungen eingehen. Atome von Elementen der 2. Periode können maximal vier Bindungen eingehen, da nur vier Atomorbitale zur Verfügung stehen. Dies wird auch als Oktettregel bezeichnet, da die Valenzschale nur acht Außenelektronen aufnehmen kann.
Unterabschnitte



Nächste Seite: Die Bindungslänge
Aufwärts: Chemische Grundlagen
Vorherige Seite: Elektronenkonfiguration
Inhalt
Oliver Krone
2003-04-28