


Nächste Seite: Mesomerie
Aufwärts: Die Atombindung
Vorherige Seite: Die Bindungslänge
Inhalt
Der räumliche Aufbau von Molekülen
Eine stark vereinfachende Darstellung von Molekülen ist die Angabe durch eine Lewis-Formel. Dabei werden Atome durch ihre Symbole und deren Valenzelektronen dargestellt, wobei einzelne Elektronen durch Punkte und Elektronenpaare durch Striche symbolisiert werden. Bindende Elektronenpaare platziert man zwischen den Atomsymbolen und freie, nichtbindende Paare werden seitlich am Atomsymbol angeordnet.
Abbildung 2.4:
Lewis-Formel des Wassers
|
Für kleine Moleküle ist die Lewis-Formel ein gutes Konzept, um die grobe Struktur zu verdeutlichen. Sie sagt aber nichts über den wirklichen, räumlichen Aufbau des Moleküls aus. Um die Molekülgeometrie exakt vorhersagen zu können, entwickelte Pauling das Konzept der Hybridisierung [Ried1990].
Ein Kohlenstoffatom besitzt im angeregten Zustand folgende Elektronenkonfiguration:
1s22s12p3. Man könnte daher annehmen, daß eine Bindung im Methan (CH4), die mit dem Elektron des s-Orbitals gebildet wird, sich von den anderen, die mit den Elektronen des p-Orbitals gebildet werden, unterscheidet. In der Realität kann man jedoch beobachten, daß Methan tetraederförmig aufgebaut ist und vier äquivalente Bindungen besitzt. Diese entstehen, wenn man das s- und die drei p-Atomorbitale miteinander vermischt oder kombiniert. Es entstehen vier identische sp3-Hybridorbitale, die untereinander einen Winkel von 109, 5o haben. Jedes Hybridorbital bildet mit dem Atomorbital eines Wasserstoffatoms eine 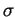 -Bindung.
Die Kombination von Atomorbitalen wird Hybridisierung genannt, wobei die Abkürzung sp3 die Zusammensetzung aus den Atomorbitalen andeuten soll. Dabei wird zwischen freien und bindenden Elektronenpaaren nicht unterschieden. Auch freie Paare können also an der Hybridisierung teilnehmen. Im Wasser (H2O) sind die Orbitale des Sauerstoffs ebenfalls tetraedisch aufgebaut. Die beiden freien Elektronenpaare besetzen je ein Hybridorbital. Sie nehmen aber geringfügig mehr Platz ein als bindende Elektronenpaare. So beträgt der Winkel zwischen den beiden Bindungen zum Wasserstoff nur etwa 104, 5o anstatt der sonst üblichen 109, 5o.
Im Ethen (C2H4), das in Abbildung 2.5 zu sehen ist, sind bei einem Kohlenstoffatom nur ein s- und zwei p-Atomorbitale an der Hybridisierung beteiligt, man spricht deshalb von einer sp2-Hybridisierung. Es entstehen dadurch drei identische Hybridorbitale. Sie sind planar in einer Ebene angeordnet und haben untereinander einen Winkel von 120o. Sie bilden mit ihrem jeweiligen Bindungspartner eine
-Bindung.
Die Kombination von Atomorbitalen wird Hybridisierung genannt, wobei die Abkürzung sp3 die Zusammensetzung aus den Atomorbitalen andeuten soll. Dabei wird zwischen freien und bindenden Elektronenpaaren nicht unterschieden. Auch freie Paare können also an der Hybridisierung teilnehmen. Im Wasser (H2O) sind die Orbitale des Sauerstoffs ebenfalls tetraedisch aufgebaut. Die beiden freien Elektronenpaare besetzen je ein Hybridorbital. Sie nehmen aber geringfügig mehr Platz ein als bindende Elektronenpaare. So beträgt der Winkel zwischen den beiden Bindungen zum Wasserstoff nur etwa 104, 5o anstatt der sonst üblichen 109, 5o.
Im Ethen (C2H4), das in Abbildung 2.5 zu sehen ist, sind bei einem Kohlenstoffatom nur ein s- und zwei p-Atomorbitale an der Hybridisierung beteiligt, man spricht deshalb von einer sp2-Hybridisierung. Es entstehen dadurch drei identische Hybridorbitale. Sie sind planar in einer Ebene angeordnet und haben untereinander einen Winkel von 120o. Sie bilden mit ihrem jeweiligen Bindungspartner eine 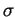 -Bindung. Ein Atomorbital ist jedoch nicht an der Hybridisierung beteiligt, es steht senkrecht zu den anderen Orbitalen. Dadurch wird die schon angedeutete
-Bindung. Ein Atomorbital ist jedoch nicht an der Hybridisierung beteiligt, es steht senkrecht zu den anderen Orbitalen. Dadurch wird die schon angedeutete 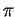 -Bindung gebildet. Die Bindungselektronen halten sich in den Atomorbitalen beider Kohlenstoffatome auf.
-Bindung gebildet. Die Bindungselektronen halten sich in den Atomorbitalen beider Kohlenstoffatome auf.
Abbildung 2.5:
Schematische Darstellung des Ethens
|
|
Im Ethin (C2H2) sind sogar zwei 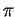 -Bindungen festzustellen, da beide Kohlenstoffatome nur sp-hybridisiert sind. Die an der Hybridisierung beteiligten Orbitale haben untereinander einen Winkel von 180o. An der Hybridisierung können auch Orbitale höherer Schalen beteiligt sein. Diese Hybridisierungsmodelle sollen aber hier nicht weiter erläutert werden.
-Bindungen festzustellen, da beide Kohlenstoffatome nur sp-hybridisiert sind. Die an der Hybridisierung beteiligten Orbitale haben untereinander einen Winkel von 180o. An der Hybridisierung können auch Orbitale höherer Schalen beteiligt sein. Diese Hybridisierungsmodelle sollen aber hier nicht weiter erläutert werden.



Nächste Seite: Mesomerie
Aufwärts: Die Atombindung
Vorherige Seite: Die Bindungslänge
Inhalt
Oliver Krone
2003-04-28