

Nächste Seite: Implementierung
Aufwärts: Bestimmung von Bindungen
Vorherige Seite: Ausgangssituation
Inhalt
Lösungsansätze
Gehen zwei Atome eine Bindung ein, kann die ungefähre Länge der Bindung abgeschätzt werden. Dabei wird eine Information genutzt, die nicht unmittelbar in einer PDB-Datei steht: der kovalente Radius eines Atoms (Abschnitt 2.2.1). Dieser Wert ist von Atom zu Atom unterschiedlich und kann daher über die Angabe des Elementtyps bestimmt werden. Mit der in Abschnitt 2.2.1 vorgestellten Methode lassen sich so die einzelnen Bindungslängen abschätzen. Durch die folgende Formel läßt sich die Länge einer Einfachbindung bestimmen. Da an den Bindungen innerhalb eines Proteins fast immer ein Element der 2. Periode beteiligt ist, kann für den Schomaker-Stevenson-Koeffizient der Wert 0,08 angenommen werden.
d (A - B) = rA + rB - 0, 08 . | xA - xB|
Atomabstand = Summe beider kovalenter Radien - 0,08 (Differenz beider EN-Werte)
Mit Hilfe der kovalenten Radien kann man ebenfalls die Länge einer Doppelbindung abschätzen. Sie ist im Gegensatz zu einer Einfachbindung um ca. 0,21 Å verkürzt. Damit hat man die theoretischen Werte für die Länge einer Einfach- bzw. einer Doppelbindung.
Durch die genaue Angabe der drei Koordinaten eines Atoms in der PDB-Datei lassen sich die Abstände untereinander berechnen. Vergleicht man diese mit den theoretischen Werten, müßte so die Wertigkeit einer Bindung bestimmt werden können.
In der Praxis läßt sich das jedoch nicht so leicht umsetzen. In den seltensten Fällen stimmen die berechneten Atomabstände mit den theoretischen Werten überein. Um trotzdem zwischen den Bindungsarten zu unterscheiden, ist ein naheliegender Lösungsansatz zunächst einmal das Intervall zwischen den Werten der Einfach- und Doppelbindung geschickt aufzuteilen. Je nachdem in welchem Teilintervall der Atomabstand liegt kann man dann die Art der Bindung festlegen.
Der kovalente Radius des Kohlenstoffs beträgt 0,77 Å. Die theoretische Länge einer C-C Einfachbindung beträgt demnach 1,54 Å und die Länge einer Doppelbindung ca. 1,33 Å. Halbiert man das Intervall und zieht bei 1,435 Å die Grenze zwischen Einfach- und Doppelbindung, läge bei einem berechneten Atomabstand von 1,44 Å eine Einfachbindung und bei einem Atomabstand von 1,43 Å eine Doppelbindung vor. Die Länge von 0,01 Å entscheidet hier also über den Charakter einer Bindung, was nicht realistisch ist. Egal wie das Intervall auch aufgeteilt wird; es werden Bindungslängen berechnet, die dazu führen, daß die Oktettregel (Abschnitt 2.2) einiger Atome nicht erfüllt ist. Ein weiterer Faktor ist, daß man bei Atomabständen, die genau auf der Intervallgrenze liegen, stark von der Wahl der kovalenten Radien abhängig ist. Kleine Unterschiede entscheiden dann über die Wertigkeit einer Bindung.
Bei der Implementierung dieses Ansatzes konnte dennoch die Wertigkeit von fast allen Bindungen korrekt bestimmt werden. Da jedoch einige Wertigkeiten nicht exakt ermittelt wurden, mußte ein anderer Ansatz gewählt werden.
Ein weiterer Lösungsansatz ist, auf die Bindigkeit eines Atoms und auf Einhaltung der Oktettregel zu achten. Da die Ladung der Atome fast nie in der PDB-Datei enthalten ist, treten jedoch sofort Probleme auf. Denn Ionen haben im Gegensatz zu ihren Atomen eine andere Bindigkeit.
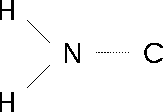
Abbildung 6.1:
Unklare Struktur einer Atomgruppe
|
In Abbildung 6.1 ist eine Atomgruppe zu sehen, bei der der Abstand zwischen dem Stickstoffatom N und dem Kohlenstoffatom C zwischen den theoretischen Werten der Einfach- und Doppelbindung liegt. Zwei verschiedene Strukturen sind aufgrund dieser Ausgangslage denkbar. Die eine Möglichkeit ist, daß das Stickstoffatom ungeladen ist und somit insgesamt drei Bindungen eingehen kann. Das Stickstoffatom besitzt dann ein freies Elektronenpaar (Abbildung 6.2a). Bei der anderen Möglichkeit ist das Stickstoffatom positiv geladen und geht somit vier Bindungen ein. Zwischen dem Stickstoff- und Kohlenstoffatom besteht also eine Doppelbindung (Abbildung 6.2b). In beiden Fällen erfüllt das Stickstoffatom die Oktettregel.
Abbildung 6.2:
Mögliche Strukturen der Atomgruppe
|
Eine genaue Aussage ist also nicht möglich. Wären alle weiteren Bindungen des Kohlestoffatoms bekannt, könnte man die genaue Struktur angeben. Denn dann läßt sich mit Hilfe der Oktettregel bestimmen, ob die unklare Bindung eine Einfach- oder Doppelbindung ist. Da aber im PDB-Format fast nie alle Wasserstoffatome angegeben werden und somit gegebenenfalls nicht alle Bindungen bekannt sind, ist es daher nicht möglich, die genaue Struktur zu bestimmen.
Dieser Lösungsansatz reicht also nicht aus, um die genaue Struktur zu ermitteln. In einem verbesserten Ansatz werden die schon berechneten Bindungen genutzt. Da bekannt ist, zwischen welchen Atomen eine Bindung besteht, lassen sich auch die Winkel untereinander berechnen. Dies wiederum gibt Aufschluß über die Hybridisierung eines Atoms und damit über die mögliche Anzahl der Bindungspartner.
Tabelle 6.1:
Hybridisierung und Winkel
| Art der Hybridisierung |
Bindungswinkel |
Anzahl der Hybridorbitale |
| sp |
180o |
2 |
| sp2 |
120o |
3 |
| sp3 |
109, 5o |
4 |
|
In der Tabelle 6.1 sind die am häufigsten vorkommenden Hybridisierungsmodelle mit den zugehörigen Bindungswinkeln aufgelistet. Über die Anzahl der Orbitale kann man auf die Anzahl der Bindungspartner schliessen, wobei vorhandene freie Elektronenpaare ebenfalls berücksichtigt werden müssen. Damit läßt sich jedoch nicht direkt auf die Wertigkeit einer Bindung schliessen. Dazu muß wieder die Oktettregel bemüht werden.
Betrachten wir wieder das Beispiel aus Abbildung 6.1 bzw. 6.2. Würde zwischen den Bindungen des Stickstoffatom ein Winkel von ungefähr 120o bestehen, kann das Atom nur zu drei weiteren Atomen eine Bindung eingehen. Eine Bindung müßte eine Doppelbindung sein. Da in diesem Fall schon drei Bindungspartner bekannt sind, muß die zweite Möglichkeit zutreffen (Abbildung 6.2b). Errechnet man jedoch einen Winkel von ungefähr 109, 5o, bildet das Atom vier Hybridorbitale und kann somit vier Bindungen eingehen, wobei ein Hybridorbital durch ein freies Elektronenpaar besetzt ist. In diesem Fall trifft die erste Möglichkeit zu (Abbildung 6.2a).
Abbildung 6.3:
Unklare Struktur einer Atomgruppe
|
Durch die Berechnung der Winkel kann man in diesem Fall auf die richtige Struktur schliessen. Es gibt aber auch Beispiele, in denen selbst dieser Lösungsansatz nicht funktioniert. In Abbildung 6.3 ist eine Atomgruppe zu sehen, bei der drei Bindungen nicht genau einzuordnen sind. Damit das Kohlenstoffatom die Oktettregel erfüllt, sind drei verschiedene Strukturen denkbar: das Kohlenstoffatom kann zu jeweils einem der drei Stickstoffatome eine Doppelbindung eingehen (Abbildung 6.4). Welche der markierten Bindungen eine Doppelbindung ist, ist jedoch nicht ersichtlich, da alle Bindungen annähernd gleich lang sind. Berechnet man die Winkel zwischen den Bindungen, stellt man fest, daß auch alle Winkel annähernd den gleichen Betrag von 120o haben. D.h. sowohl das Kohlenstoffatom als auch die drei Stickstoffatome sind sp2-hybridisiert. Da jedes Stickstoffatom bereits zu drei weiteren Atomen eine Bindung eingeht, müßte eine davon eine Doppelbindung sein. Demnach wären alle markierten Bindungen Doppelbindungen. Dann hätte das Kohlenstoffatom zwölf Außenelektronen, was eindeutig der Oktettregel widerspricht.
Abbildung 6.4:
Mögliche Strukturen der Atomgruppe
|
Der reale Zustend ist, daß die 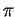 -Elektronen über die drei Stickstoffatome und dem Kohlenstoffatom verteilt sind, wodurch besonders stabile Bindungsverhältnisse erreicht werden. Es liegt also die in Kaitel 2.2.3 beschriebene Mesomerie vor. Die genaue Struktur kann nicht mit einer Formel, sondern nur durch drei Grenzstrukturen beschrieben werden. Dabei hat jede der drei Bindungen zu 1/3 Doppelbindungscharakter.
Bei der Implementierung dieses Ansatzes hat sich zudem ein weiteres Problem ergeben. Es wurden Winkelwerte berechnet, die nicht exakt den theoretischen Werten von 120o oder 109, 5o entsprechen. Bei einem berechneten Wert von 115o läßt sich nur schwer das entsprechende Hybridisierungsmodell bestimmen.
Es läßt sich also bestimmen, zwischen welchen Atomen eine Bindung besteht. Die genaue Wertigkeit läßt sich jedoch in einigen Fällen nicht exakt angeben. Das liegt daran, daß eine Bindung nicht nur nach Einfach- und Doppelbindung eingeteilt werden kann. Es liegen häufig Mischformen beider Arten vor. Um keine falschen Werte in der generierten CML-Datei anzugeben, wird aus diesem Grund die Wertigkeit einer Bindung nicht mit angegeben.
-Elektronen über die drei Stickstoffatome und dem Kohlenstoffatom verteilt sind, wodurch besonders stabile Bindungsverhältnisse erreicht werden. Es liegt also die in Kaitel 2.2.3 beschriebene Mesomerie vor. Die genaue Struktur kann nicht mit einer Formel, sondern nur durch drei Grenzstrukturen beschrieben werden. Dabei hat jede der drei Bindungen zu 1/3 Doppelbindungscharakter.
Bei der Implementierung dieses Ansatzes hat sich zudem ein weiteres Problem ergeben. Es wurden Winkelwerte berechnet, die nicht exakt den theoretischen Werten von 120o oder 109, 5o entsprechen. Bei einem berechneten Wert von 115o läßt sich nur schwer das entsprechende Hybridisierungsmodell bestimmen.
Es läßt sich also bestimmen, zwischen welchen Atomen eine Bindung besteht. Die genaue Wertigkeit läßt sich jedoch in einigen Fällen nicht exakt angeben. Das liegt daran, daß eine Bindung nicht nur nach Einfach- und Doppelbindung eingeteilt werden kann. Es liegen häufig Mischformen beider Arten vor. Um keine falschen Werte in der generierten CML-Datei anzugeben, wird aus diesem Grund die Wertigkeit einer Bindung nicht mit angegeben.
Was dennoch zu einer Bindung angeben werden kann, ist die Bindungslänge, die einen relativ guten Aufschluß über den Charakter einer Bindung gibt. Diese Information kann dann an anderer Stelle genutzt werden, um die Art einer Bindung zu beschreiben.



Nächste Seite: Implementierung
Aufwärts: Bestimmung von Bindungen
Vorherige Seite: Ausgangssituation
Inhalt
Oliver Krone
2003-04-28